在經歷十年的討論中,立法院終於在2024年6月三讀通過再生醫療雙法,雙法包含《再生醫療法》及《再生醫療製劑條例》,其目的是為了替現行治療無效的患者,如:癌症末期病患等,提供其他醫療選項,我國也成為全球第三個,設立再生醫療專法的國家。而再生醫療雙法的適用對象?重點?相關Q&A,就讓這篇再生醫療懶人包繼續看下去吧!
更多閱讀
再生醫療法是什麼?
- 根據衛福部資料,「再生醫療」是將細胞、基因用於人體構造或功能的重建或修復,又或是用在人體疾病的治療或預防上。像是重度燒燙傷者,可透過培養皮膚細胞層片進行移植,又或是可以培養細胞用在癌症細胞治療、心臟破損修復等,甚至是利用抽血、基因轉殖培養胚胎幹細胞,投入器官移植等。
- 而「再生醫療法」及「再生醫療製劑條例」則是分別用來規範如醫療機構、醫師執行再生醫療技術或是製劑的行為,以及再生醫療製劑商品化、規格化。透過立法確保醫療機構執行再生醫療技術、再生醫療製劑的安全品質及有效性,是維護病人接受治療權益的重大里程碑,能嘉惠更多有需要的人,讓全民的健康更有保障。
什麼是「再生醫療雙法」?
- 2022年訂定「再生醫療三法」,分別是《再生醫療發展法》、《再生醫療製劑管理條例》以及《再生醫療施行管理條例》。
- 但因為《再生醫療發展法》和《生技醫藥產業發展條例》有重疊之處,最終取消《再生醫療發展法》。
- 後於2023年2月16日通過《再生醫療法》、《再生醫療製劑條例》草案,也就是今日的「再生醫療雙法」。
- 於2024年6月4日完成三讀通過「再生醫療法」及「再生醫療製劑條例」(下合稱「再生醫療雙法」),並於2024年6月19日經總統公布,以法律位階規範再生醫療技術及藥品。
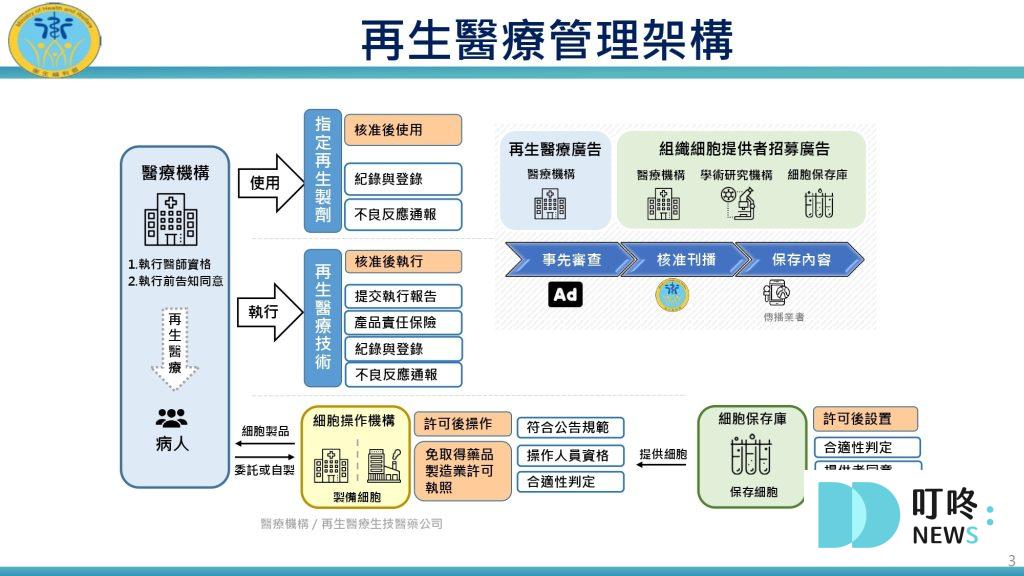

什麼是「再生醫療」?
利用基因、細胞及細胞衍生物,治療、修復、替換人體細胞、組織、器官的一種新興治療方式,其範圍包含「再生醫療技術」與「再生醫療製劑」。
為何推動再生醫療雙法?
- 提供民眾多一種治療選擇。
- 研發創新醫療方式對抗不治之症,挽救更多生命。
- 確立我國再生醫療制度規範,保障病人權益與治療品質。
- 促進國內再生醫療產業發展,接軌國際趨勢。

再生醫療法適用對象
再生醫療受惠3大族群
神經退化性疾病
- 再生醫療預計能夠取代過去的組織療法(tissue therapies),來幫助許多因退化所帶來的疾病。例如:退化性關節炎、阿茲海默症、缺血性腦中風、脊髓損傷、心臟衰竭、腎臟衰竭、黃斑部病變、帕金森氏症。
- 例如因腎臟數量不足,再生醫學技術可以使洗腎患者不需再漫長地等待他人的器官捐贈,又可免除器官移植時的排斥問體。

癌症
- 再生醫療技術也能針對癌症做治療,研究顯示,透過再生醫療技術可以增加腸道內硫化氫的消耗與氧氣的製造,創造缺氧和腫瘤微環境的調節,以抑制腫瘤生長,並使大腸直腸癌獲得治療。
- 也能從癌症患者體內抽取並分離出特定免疫細胞,培養、擴增數量後,再將細胞製劑注入患者體內以攻擊癌細胞,成為治療的新方法之一。

糖尿病
- 糖尿病是許多人的夢魘,尤其足部潰瘍是併發症的主要原因,而再生醫療可以促進生長因子的分泌,並顯著提高傷口癒合的速度和品質。
- 再生醫學發展之今,無論是第一型糖尿病或是第二型糖尿病都已有動物研究證實,也期待臺灣修法通過後的研究及治療進度,能取得更好的發展。

再生醫療法三讀通過內容
再生醫療法的通過,除促進再生醫療領域發展,亦加速再生醫療研發成果擴大應用至臨床醫學。全文共計35條七章節,重點如下:
- 研究發展促進:為確保提供病人安全有效之治療,醫療機構執行再生醫療前應進行並完成人體試驗,以促進再生醫療研究發展,予以獎勵或補助。

- 再生技術管理:明定醫療機構執行再生醫療之範疇、執行醫師之資格及應向病人充分說明相關權利義務等事項,以確保再生醫療之安全、品質及有效性。

- 細胞源頭管理:細胞操作執行機構及細胞保存庫,應對組織、細胞提供者進行合適性判定。

- 加重罰則:因再生醫療之執行影響病人生命、身體或健康甚鉅,除加重對非醫療機構執行再生醫療或為再生醫療廣告之處罰至最高2千萬元外,非醫療機構執行再生醫療,得沒入其執行再生醫療之設備及再生製劑。
衛生福利部透過立法呼應再生醫療之臨床實務管理需求及產業發展需求,對確保再生醫療安全、品質及有效性,維護病人權益,至為關鍵。
再生醫療法常見問題Q&A
Q1:再生醫療法草案階段關於胎兒權益爭議?
A:新法特別明定,應取得法定代理人、監護人書面同意,並經公證始升效力,胎兒不做為細胞、組織提供者,須以有意思能力的成年人為限。不過,顯有益於治療特定人口群且未能以其他對象取代者不在此限。
- 無行為能力者、無意思能力、限制行為能力人。
- 受輔助宣告、監護宣告者。
Q2:再生醫療產品為什麼昂貴?
A:在發展階段,研究發展和生產再生治療產品勢必需要投入大量的資金,加上臺灣市場較小,導致費用昂貴。
Q3:是否可以人體試驗?
A:
- 衛福部醫事司長劉越萍表示,先前的草案曾免除人體試驗的條件,其中包括有初步療效者,但考量到可能受到實驗設計影響,因此刪除這部分。
- 再生醫療現在可免除人體試驗的條件只剩下恩慈療法、特管辦法已核准執行的項目。
- 特管辦法目前可在國內核准的醫療機構執行的項目有:
- 自體免疫細胞項目。
- 自體脂肪幹細胞項目。
- 自體骨髓間質幹細胞項目。
- 自體纖維母細胞項目。
- 自體軟骨細胞項目。
Q4:是否開放醫院成立再生醫療公司?
A:
- 為避免醫生與病人之間的利益衝突,本次通過的法案禁止醫療機構設立再生醫療生技公司。
- 違者可處新台幣200萬元以上、2000萬元以下罰鍰。
Q5:胚胎幹細報研究?
A:現行的「人類胚胎及胚胎幹細胞研究倫理政策指引」規定,禁止胚胎和胚胎幹細胞研究,並將規定提升至法律位階。
Q6:再生醫療可以治什麼病?
A:可以治療血液疾病、心臟病、糖尿病、脊髓損傷和神經退化性疾病。
Q7:細胞治療成效是否對外公布?
A:再生醫療法草案第24條規定,對於醫療機構執行再生醫療技術的治療效果及統計,衛福部應每年定期公開,以維護民眾權益,公開內容包含核准醫療機構家數、總收案人數、不良事件及臨床評估指標。
Q8:再生醫療雙法上路後,特管辦法會退場嗎?
A:再生醫療雙法上路前,細胞治療由「特定醫療技術檢查檢驗醫療儀器施行或使用管理辦法」,簡稱「特管辦法」規範,目前開放自體免疫細胞、自體脂肪幹細胞、自體骨髓間質幹細胞、自體纖維母細胞及自體軟骨細胞等可在國內核准的醫療機構施行。
今天審查再生醫療雙法草案時,以附帶決議通過,再生醫療法施行後,特管辦法第二章第一節的細胞治療技術部份,即公告廢止。
總結
再生醫療雙法三讀通過,標誌著台灣生技和醫療的嶄新里程碑。這一法案的通過,不僅為台灣的再生醫療領域帶來了更多發展機遇,也展現了政府對於推進科技創新和提升醫療水準的承諾。
《本網站提供的訊息為個人經驗及網路資訊分享,並不具有可以取代醫師、治療師、護理師或其他專業醫護人員的專業意見或治療建議的效益。如須尋求專業醫療診斷、建議或治療,請與醫師或其他專業且合格合法醫護人員諮詢。》











